Кримско-конгонската хеморагична треска (CCHF) е тешка болест која се пренесува преку крлежи со широка географска дистрибуција и стапка на смртност од 40% или повисока. Предизвикани од инфекција со вирусот CCHF (CCHFV), случаи се пријавени низ Африка, Блискиот Исток, Азија и јужна и источна Европа. Растечкиот опсег на векторот на крлежот Hyalomma ги става новите популации во ризик за CCHF, а не постојат лиценцирани вакцини или специфични антивирусни средства за лекување на CCHF. Понатаму, и покрај случаите на CCHF кои се пријавуваат годишно, домаќинот и вирусните детерминанти на патогенезата на CCHFV се слабо разбрани. CCHFV може продуктивно да зарази мноштво животински видови, но само луѓето развиваат тешка болест. Во рамките на човечката популација, субклиничките инфекции се недоволно ценети и може да претставуваат значителен дел од клиничките резултати. Во споредба со другите членови на редот Bunyavirales, CCHFV има посложена геномска организација, со многу вирусни протеини кои имаат нејасни функции во вирусната патогенеза. Во последниве години, подобрените животински модели доведоа до зголемени увиди во патогенезата на CCHFV, а неколку антивирусни и вакцини за CCHFV покажаа силна ефикасност во претклиничките модели. Преводот на овие сознанија и кандидатски терапевти во клиниката се надеваме дека ќе ги намали морбидитетот и морталитетот предизвикани од CCHFV.

Вирусот на Кримско-Конго хеморагична треска (CCHFV) првпат беше пријавен во 1960-тите како причина за фебрилни болести во Конго1. Истражувањето на фебрилни болести на Крим покажа дека вирусот одговорен за овие случаи е антигенски идентичен со причинителот на болестите во Конго2. Оттогаш, серолошките студии и пријавените случаи на луѓе покажуваат дека CCHFV е широко распространет вирус на хеморагична треска ендемичен низ Африка, Блискиот Исток, Југоисточна Азија и јужна и источна Европа, внимателно следејќи го опсегот на неговиот крлеж Hyalomma резервоар домаќин. Студиите идентификуваа крлежи од родот Hyalomma како главен вектор и резервоар на CCHFV, иако другите видови крлежи може да имаат улога во одржувањето на CCHFV во ендемските региони. Долг транспорт на птици инфицирани со CCHFV крлежи5, глобалната трговија што води до воведување вектори на крлежи на нови континенти6 и климатските промени што доведуваат до проширување на опсегот на крлежот Hyalomma до север до Шведска сугерираат дека географскиот опсег на CCHFV ќе продолжи да се прошири. Серолошките студии покажаа дека CCHFV може продуктивно да зарази разновидни диви животински видови како што се зајаци, мали глодари, ноеви, биволи, па дури и носорози и, што е важно за изложеност на луѓето, добиток без очигледна болест . Овие животински видови служат како важни домаќини за засилување за CCHFV, овозможувајќи му на CCHFV да се шири од инфицирани крлежи до неинфицирани крлежи преку ко-хранење или хранење со виремично животно9. Луѓето најчесто се заразуваат со CCHFV преку каснувања од крлежи или ракување и касапење на заразениот добиток. При инфекција, CCHF започнува како неспецифична фебрилна болест која потоа може да напредува до тешки хеморагични манифестации. Стапките на смртност од случаи се разликуваат, но може да бидат повисоки од 30% во некои региони. Во моментов нема одобрени вакцини или терапевтски средства за CCHF. Во последниве години, добивме подобрено разбирање за функцијата на CCHFV протеините при вирусна репликација, а подобрените животински модели обезбедија важен увид во патогенезата на CCHFV и овозможија претклиничко тестирање на повеќе платформи за вакцини и терапевтски стратегии за CCHF. Во овој преглед, ние се фокусираме на неодамнешните сознанија добиени за функцијата на вирусните протеини во патогенезата на CCHFV заедно со нашето сегашно разбирање за CCHF и состојбата на третманите и вакцините за CCHFV.

Молекуларна биологија на CCHFV
CCHFV е обвиен РНК вирус со негативна смисла, кој припаѓа на родот Ортонаировирус во семејството Nairoviridae од редот Bunyavirales. Покрај CCHFV, семејството Nairoviridae се состои од вируси кои се пренесуваат преку членконоги, како што се вирусот на овча болест Најроби, вирусот Дугбе и вирусот Хазара (HAZV), иако овие вируси се чини дека предизвикуваат малку-никаква болест кај луѓето. Како и кај другите бунијавируси, три-сегментираниот вирусен геном е обложен со вирусниот нуклеопротеин (NP) и врзан со L протеинот. Вирусните протеини се кодирани од три геномски сегменти, а во однос на другите членови од редот што можат да предизвикаат човечка болест, CCHFV има посложена геномска организација (дискутирана подолу). При влегувањето, овие протеини произведуваат вирусна РНК со позитивна смисла користејќи ја геномската вирусна РНК со негативна смисла како образец за иницирање на производство и репликација на вирусни протеини. Вирусните гликопротеини Gn и Gc се наоѓаат на вирионската површина и се одговорни за врзување на рецепторот и влез на вирусот.
Вирусот на Кримско-Конго хеморагична треска (CCHFV) е обвиен, три-сегментиран, РНК вирус со негативна смисла. Вирионот е обложен со гликопротеините Gn и Gc, кои посредуваат во врзувањето и влезот на рецепторот. Некои докази сугерираат дека дополнителниот протеин GP38 се наоѓа и на вирионот, но ако е така, со нејасна локализација или функција. б, Трите геномски сегменти на CCHFV се малите (S), средни (M) и големите (L) сегменти. Сегментот S го кодира вирусниот нуклеопротеин (NP) во една рамка за читање и малиот неструктурен протеин (NSs) во отворена рамка за читање со спротивна смисла. Сегментот М е комплексен, кодирајќи гликопротеински прекурсор (GPC) кој се обработува од протеази домаќин за да се произведе домен GP160/85 кој понатаму се обработува до домен сличен на муцин (MLD) и GP38, Gn и Gc гликопротеините и медиумот неструктурен протеин (NSm). L сегментот на CCHFV е невообичаено голем за бунијавируси, а кодираниот протеин содржи вирусна РНК-зависна РНК полимераза (RdRP) и протеаза слична на тумор на јајниците (OTU) на N-крајот. в, при прицврстување (стадиум 1), CCHFV се подложува на влез зависен од клатрин и зависен од pH во цитоплазмата на домаќинот (фази 2 и 3). По влегувањето во цитоплазмата, вирусните геноми се претвораат во мРНК со позитивна смисла преку RdRP и иницираат транслација на вирусни протеини. Овие протеини, исто така, се координираат за да произведат нови вирусни геноми со негативна смисла кои се обложени со NP и врзан L протеин за да иницираат репликација при инфекција на следната клетка (фаза 4). GPC се преведува во ендоплазматскиот ретикулум (ER) и за време на трговијата преку ER и Golgi апаратот протеолитички се обработува за да произведе зрели гликопротеини заедно со помошните протеини MLD, NSm и GP38. Новопроизведените геноми се пакуваат во обвиени честички и вирусот пупки во апаратот Голџи за ослободување преку секреторниот пат. Потоа се ослободуваат нови вириони за да инфицираат дополнителни клетки, додека GP160/85, MLD и GP38 исто така се ослободуваат екстрацелуларно, но со нејасни последици. Покрај олеснувањето на вирусната репликација, CCHFV протеините исто така ја блокираат апоптозата на домаќинот и вродените имуни патишта. CCHFV NP може да го блокира внатрешниот пат на апоптоза на чекор допрва да се дефинира, додека CCHFV NSs промовира апоптоза преку нарушување на митохондријалната мембрана или надворешните апоптотични патишта. CCHFV, исто така, може да промовира апоптоза преку производство на фактор на туморска некроза (TNF) и патека на рецепторот на смртта TNF. CCHFV NP е исто така расцепен од домаќинот каспаза 3, но олигомерните конформации може да го блокираат ова расцепување. OTU доменот на протеинот CCHFV L го блокира RIG-I-зависното започнување на одговорот на интерферонот од типот I преку неговата функција за деубиквитилирање. MAVS, митохондријален антивирусен сигнален протеин; vRNA, вирусна РНК.
S сегмент
Малиот геномски сегмент (S) го кодира вирусниот NP заедно со малиот неструктурен протеин (NSs) во рамка за читање со спротивна смисла (сл. 1б). Покрај интеракциите со вирусната РНК за да се формираат рибонуклеопротеински комплекси, НП поседува ендонуклеазна активност, комуницира со протеините од топлински шок на домаќинот за време на интрацелуларната вирусна репликација и во заразните честички, и промовира транслација на вирусни mRNA, покажувајќи мултифакторна улога за НП во животниот циклус на CCHFV. NP и NSs, исто така, може да ја модулираат апоптозата на клетката домаќин, што сугерира дека регулацијата на апоптозата на клетката домаќин е важна за животниот циклус на CCHFV. Инфекцијата со CCHFV индуцира апоптоза на клетката домаќин in vitro и in vivo, а биомаркерите на апоптозата се нагоререгулирани кај пациенти инфицирани со CCHFV. Сепак, не е јасно дали апоптозата на домаќинот е провирусна или антивирусна. Инхибицијата на апоптозата на домаќинот ин витро резултираше со зголемени вирусни титри што укажуваат на антивирусен ефект. CCHFV NP може да ја потисне активацијата на каспаза 3 и каспаза 9, и индукција на апоптоза предизвикана од BAX и ослободување на цитохром c од митохондриите, иако не е јасно каде во внатрешната патека на апоптоза NP ја блокира активацијата18. Заедно, овие податоци покажуваат дека апоптозата на домаќинот може да врши антивирусна активност против CCHFV и дека CCHFV го користи својот NP протеин за да го потисне овој одговор на домаќинот. Сепак, CCHFV NSs може да го наруши потенцијалот на митохондријалната мембрана, со што се активира апоптоза, а подоцна за време на инфекцијата, CCHFV индуцира активирање на BID (про-апоптотички протеин), веројатно преку надворешни апоптотични сигнали18, што сугерира дека CCHFV исто така може да промовира апоптоза. Понатаму, CCHFV NP и поврзаниот HAZV NP содржат високо зачуван DEVD или DQVD мотив на расцепување, соодветно, кој е расцепен од домаќинот каспаза 3 . Иако беше предложено дека расцепувањето на НП со каспаза 3 може да биде одбрана на домаќинот против CCHFV17, структурните студии покажаа дека олигомерните конформации на НП резултираат со заштита на овој мотив од каспаза 3 на домаќинот. Така, NP може да се расцепи од домаќинот каспаза 3 само кога е присутен во специфични конформации. Мутацијата на вирусниот НП за да се елиминира расцепувањето на каспаза 3 резултираше со зголемена активност на вирусна РНК полимераза, што сугерира дека расцепувањето на НП може да ја регулира синтезата на вирусната РНК. Сепак, заразните HAZV и CCHFV можеа да се спасат кога мотивите што може да се расцепат беа заменети со нерасцеплив мотив DQVE или AEVA, соодветно, а мини-репликонскиот систем CCHFV покажа еквивалентна известувачка активност помеѓу дивиот тип NP и NP со изменет мотив DEVD1, демонстрирајќи дека расцепувањето на домаќинот каспаза на овој мотив кај ортонаировирусите не е суштинско за вирусната репликација. Интересно, заразниот HAZV кој поседува слично нерасцеплив мотив AQVA не може да се спаси, што укажува на тоа дека овој мотив може да има важни функции различни од расцепувањето на каспаза. Високата конзервација на мотивот DEVD во CCHFV дополнително сугерира дека секоја антивирусна активност на домаќинот извршена преку расцепувањето на НП на каспаза 3 е компензирано со сè уште нејасните провирусни функции. Улогата на апоптозата на клетката домаќин и каспазите во CCHFV инфекцијата може да биде различна кај домаќините од цицачи и крлежи. Растот на HAZV во клетките на крлежот не предизвика апоптоза ниту, пак, HAZV NP беше расцепен од каспази од крлежи, но сепак CCHFV што го поседува нерасцепливиот мотив AEVA не успеа да порасне во клеточна култура на крлеж.

Генетска разновидност
Соодветно на неговата широка географска дистрибуција, CCHFV е генетски разновиден вирус. Иако NP и L протеините на соевите CCHFV се конзервирани со приближно 95% или повеќе аминокиселини зачувани помеѓу соеви, CCHFV GPC е многу помалку зачуван, со дивергентни соеви кои покажуваат помалку од 75% зачувување на аминокиселините. Генетската разновидност на CCHFV е во силна корелација со географијата, а кладите на CCHFV се сегрегираат врз основа на географската локација. Не е познато какви селективни притисоци ја поттикнуваат секвенциската разновидност на CCHFV низ неговиот географски опсег. Имајќи предвид дека луѓето се случајни домаќини за CCHFV, селективните притисоци кои делуваат на CCHFV веројатно се јавуваат во резервоарот за крлежи или во домаќините за засилување на цицачите. Интересно е што соевите на CCHFV изолирани од слични региони оддалечени со децении покажуваат силна зачувување на секвенцата, што сугерира дека временската еволуција на CCHFV во географските региони е ограничена. Наместо тоа, генетската разновидност може да произлезе од миграцијата на долг дострел. Видовите на CCHFV кои циркулираат во југозападна Европа се групираат со африкански, а не со источноевропски изолат, што укажува на долгорочно воведување на CCHFV во Европа од Африка, потенцијално преку птици преселници кои носат крлежи инфицирани со CCHFV5. Дополнително, сегментираниот геном на CCHFV може да биде подложен на ресортиман, а CCHFV изолатите кои поседуваат геномски сегменти со различни географски линии се користени за да се идентификува историската миграција и коциркулацијата на CCHFV на долги географски растојанија.

Пренос на луѓе и фактори на ризик
Ендемичноста на CCHFV е тесно поврзана со географската дистрибуција на главниот вектор и резервоар на членконоги, Hyalomma . Како вирус што се пренесува преку членконоги, CCHFV се пренесува на луѓето првенствено преку каснување или ракување со инфициран крлеж, а во ендемските региони, каснувањата од крлежи може да бидат вообичаени и не се препознаваат како фактор на ризик за CCHFV инфекција. CCHFV, сепак, може да се пренесе и на луѓето преку директен контакт со крв или ткива на виремични животни, главно добиток. Така, изложеноста на висок ризик постои за луѓето со активности на отворено (на пример, војници, земјоделци, шумски работници и планинари) и оние кои имаат близок контакт со добитокот (на пример, овчари, фармери, месари, работници во кланици и ветеринари). Дополнително, порастот на CCHFV може да се забележи за време на религиозните фестивали како што е Курбан Бајрам во кој добитокот потенцијално заразен со CCHFV се транспортира од руралните во урбаните области за колење од потенцијално необучени поединци. Пријавени се болничко и внатресемејно пренесување преку иглички или контакт со крв и секрет од пациентите, со што здравствените работници и членовите на блиското семејство вклучени во стационарната нега се изложени на ризик. Може да биде возможен пренос на CCHFV за време на медицински процедури кои генерираат аеросоли или сексуален контакт. Сепак, преносот на CCHFV од човек на човек се чини дека е неефикасен, а широко распространетите епидемии што се одржуваат преку пренос од човек на човек, како што се оние што се случиле повеќе пати со EBOV , не биле пријавени за CCHFV.
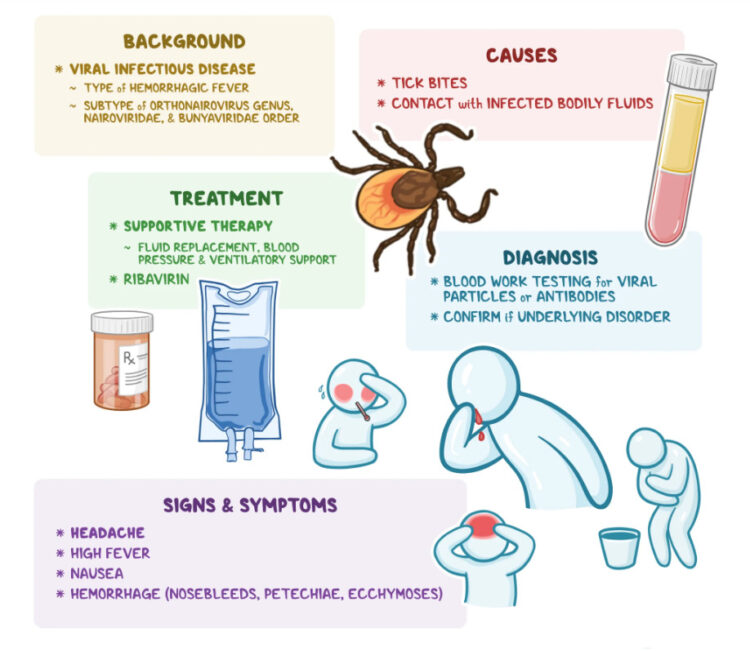
Кримско-Конго хеморагична треска
Серолошките докази покажуваат дека CCHFV може продуктивно да зарази широк спектар на домашни и диви животински видови од зајаци до говеда до ноеви до желки, но сепак само луѓето развиваат симптоматска болест. Кај луѓето, CCHF може да прикаже различни исходи кои се движат од асимптоматски и благи инфекции до тешка и понекогаш смртоносна болест64,73. Клиничката дијагноза на CCHF е тешка бидејќи почетните симптоми се слични на оние на другите фебрилни болести (Рамка 1). Затоа, лабораториското тестирање има клучна улога во управувањето со случаи и контролата на епидемијата (Рамка 2).
CCHF се манифестира во четири различни фази: инкубација, пред-хеморагичен, хеморагичен и реконвалесценција. Периодот на инкубација е обично помалку од една недела (во опсег од 1-9 дена) и зависи од патот на изложеност и дозата на вирусот. Се чини дека е најкратко по каснување од крлеж (обично 1-3 дена) и малку подолго по изложување на крв, ткиво и секрет на заразени добиток и луѓе (5-6 дена). Пред-хеморагичниот стадиум трае во просек околу 2-4 дена (во опсег од 1-7 дена) и започнува нагло со прилично неспецифични симптоми вклучувајќи треска (39-41°C), главоболка, мијалгија, вртоглавица, болки во вратот и вкочанетост, болки во грбот, главоболка, болки во очите и фотофобија. Ова може да биде придружено со болки во грлото, абдоминална болка, гадење, повраќање и дијареа. Може да се забележи и хиперемија на лицето, вратот и градниот кош, затнат склер и конјунктивитис и жолтица64. Во тешки случаи, забележани се промени во расположението и сетилната перцепција. Сомноленцијата може да ја замени агитацијата. Може да бидат присутни и хепатомегалија и спленомегалија.
Хеморагичниот стадиум е обично краток (приближно 2-3 дена), но може да се продолжи до 2 недели. Хеморагичните манифестации се движат од петехија до проширени ехимози на мукозните мембрани и кожата, наод особено изразен со CCHF во споредба со другите вирусни хеморагични трески (VHFs). Епистакса, мелена, хематемеза, хематурија и хемоптиза се чести како и крварење од местата на инјектирање. Повремено е забележано крварење од други места како што се вагината, матката и мозокот. Хематологијата и хемијата на крвта најчесто покажуваат тромбоцитопенија, леукопенија и покачени нивоа на аспартат аминотрансфераза (AST), аланин аминотрансфераза (ALT), лактат дехидрогеназа и креатин фосфокиназа заедно со покачени нивоа на инфламаторни, Коагулацијата може да биде засегната, со продолжено време на протромбин и активирано парцијално тромбопластинско време придружено со намалување на нивоата на фибриноген и зголемување на нивоата на производи за деградација на фибриноген. Хеморагичниот стадиум е изразен во тешки случаи, со брза прогресија до дисеминирана интраваскуларна коагулација, очигледно крварење, бубрежна, црнодробна или пулмонална инсуфициенција и шок. Ако е смртоносна, смртта обично се јавува во втората недела од болеста.
Кај преживеаните, опоравувањето генерално започнува околу 9-10 дена по почетокот на болеста (опсег 9-20 дена) и е поврзано со враќање во нормала за лабораториските параметри. Оваа фаза може да биде продолжена и може да биде поврзана со хипотензија, тахикардија или брадикардија, полиневритис, проблеми со дишењето, ксеростомија, недостатоци на видот и слухот, губење на косата и губење на меморијата, меѓу другото. Не постојат сигурни докази за релапс или бифазен тек на болеста; сепак, последиците не се доволно добро проучени за да се одредат долгорочни компликации. Преживеаните обично развиваат хуморален и клеточен имунитет против CCHFV.
Корелати на исходот на болеста
Виремијата има прогностичко значење за исходот на CCHFV инфекција. Пациентите со титри кои надминуваат 109 копии на геном на милилитар плазма имаат поголема веројатност да имаат смртоносна болест, а средните вредности за фатални случаи се >1.000 пати повисоки од оние на пациентите кои преживеале. Заедно со високата виремија, раните клинички лабораториски критериуми (до 5 дена по почетокот) кои може да предвидат фатален исход се тромбоцитопенија (≤150.000 тромбоцити на микролитар), покачени нивоа на AST и ALT и покачени нивоа на проинфламаторни цитокини. Дополнително, очигледната дисеминирана интраваскуларна коагулација, хематемеза, мелена и сомноленција беа поврзани со фатални исходи. Развиени се системи за бодување кои сеопфатно ги проценуваат пациентите за повеќе фактори на ризик и се точни предиктори за смртта. Раните одговори на антителата на домаќинот исто така може да бидат предиктор за исходот на болеста. Одговорите на антителата на CCHFV може да бидат брзи, со CCHFV-специфичен IgM што може да се открие веднаш 2-3 дена по почетокот на симптомите и CCHFV-специфични IgG во рок од 5-6 дена. Отстранувањето на виремијата е во корелација со раните IgM одговори96, додека во фатални случаи, има малку докази за одговор на антитела против CCHFV, што укажува дека неуспехот да се монтира анти-CCHFV хуморалниот имунитет може да резултира со смртоносни исходи.
Придонесите на вирусните детерминанти за сериозноста на болеста се непознати и не е јасно дали генетската разновидност на CCHFV придонесува за разновидните стапки на смртност пријавени низ ендемските региони. Високо дивергентна лоза на CCHFV првпат препознаена во Грција99 може да биде причина за висока серопреваленца без поврзани клинички случаи во овој регион, што укажува на намален човечки патоген потенцијал100,101. Тежината на болеста веројатно е и функција на патот на изложеност, количината на вирусот за инокулација и нивото на јавно-здравствени ресурси достапни за лекување на инфекции со CCHFV. Генетиката на домаќинот, исто така, може да придонесе за исходот на болеста102,103,104,105,106,107. Субклиничките инфекции со CCHFV веројатно се недоволно ценети, а подоброто препознавање на поблаги случаи на болеста може да ги промени стапките на смртност.

Модели на глодари
Иако првично се користеа главно за вирусно размножување, глувците што цицаат покажуваат смртоносна болест при инфекција со CCHFV и се користени за проценка на ефикасноста на антивирусни и моноклонални антитела. Во поново време, возрасни глувци со недостаток на интерферон тип I преку генетски дефицит во IFNα рецепторот (Ifnar-/-), минливо потиснување на сигнализацијата на IFNAR или генетски недостаток во сигналниот трансдуцер и активатор на транскрипција 1 (Stat1-/-) се користени како модели на смртоносен CCHFV21. Хрчаците со недостаток на STAT2 се исто така подложни на смртоносна CCHFV инфекција. Во овие модели, болеста е типично поврзана со неконтролирана вирусна репликација, инфламаторни имунолошки реакции, патологија на црниот дроб и на крајот смрт. Смртоносната болест кај овие модели на глодари има слични корелации со смртоносните болести кај луѓето, што укажува на тоа дека слични механизми на болеста може да резултираат со смртоносни исходи кај заразените глувци, хрчаци и човечки пациенти. Овие модели беа вредни алатки за претклиничка евалуација на антивирусни средства, моноклонални антитела, вакцини и терапии насочени кон домаќинот.

Моделите на глувци, исто така, обезбедија вреден увид во патогенезата на CCHFV. Кај глувците, хепатоцитите и ендотелните клетки се цел на CCHFV инфекција, а вирусната репликација во овие ткива може да биде причина за оштетување на црниот дроб и васкуларна дисфункција забележани во случаите на CCHF. Инфекцијата на моноцитите со CCHFV, исто така, може да придонесе за прогресија на болеста. Инфекцијата на вродените имунолошки клетки како што се моноцитите и макрофагите со EBOV доведува до нерегулиран и огромен воспалителен одговор, централна карактеристика на неколку VHFs. Глувците со недостаток на интерферон од тип I инфицирани со CCHFV покажуваат многу карактеристики на нерегулиран воспалителен имунолошки одговор, што сугерира дека механизмите на имунопатогенезата кај CCHF се слични на оние што се гледаат кај другите VHF. Транзиторната супресија на сигнализирањето на интерферон од тип I преку администрација на антителото MAR1-5A3 што го блокира IFNAR е искористено за да се испита инфекцијата со CCHFV кај нокаут глувците за да се оцени придонесот на домаќинот кон болеста. Користејќи ја оваа минлива супресија, глувците инфицирани со CCHFV со недостаток на адаптивен имунитет (Rag2-/-) или перфорин покажаа тешка патологија на црниот дроб, што покажува дека оштетувањето на црниот дроб се случило во отсуство на цитотоксични Т-клетки. Наместо тоа, активирањето на суперфамилијата на туморскиот некроза фактор (TNF) и екстензивната апоптоза кај заразените црн дроб сугерираат дека патологијата на црниот дроб може да се појави преку индукција на апоптоза во инфицирани и неинфицирани случајни клетки. Понатамошните студии покажаа дека CCHFV инфекцијата на глувците со недостаток на митохондријален антивирусен сигнален протеин (MAVS) и третирани со антитела за блокирање на IFNAR биле заштитени од болести, што сугерира дека во отсуство на тип I интерферон, сигнализацијата MAVS може да придонесе за лоши резултати. Дополнително, во овој модел, блокадата на TNF преку третман со неутрализирачки антитела може да заштити од смрт. Заедно, овие податоци сугерираат дека воспалителните реакции на домаќинот придонесуваат за морбидитетот и морталитетот при инфекција со CCHFV. Во модел на глушец кој ја рекапитулира фазата на закрепнување на болеста, исцрпувањето на ЦД4+ и/или ЦД8+ Т-клетките или блокадата на сигнализацијата на IFNγ резултираше со намалено преживување, што сугерира дека клеточниот имунитет и интерферонот тип II вршат контрола врз инфекцијата со CCHFV. Понатаму, хуманизираните глувци (NSG-SGM3) пресадени со човечки матични клетки развија исходи на болеста специфични за сојот CCHFV, кои се движат од блага, самоограничувачка болест до прогресивна смртоносна болест. Фаталната болест беше поврзана со вирусна репликација во глијалните клетки и тешка невролошка болест. Овој модел може да биде корисен за проучување на потенцијалната невролошка инволвираност на CCHFV.

Конверзијата на асимптоматска инфекција со CCHFV кај имунокомпетентни глувци во брзо смртоносна инфекција кај глувците со недостаток на интерферон тип I покажува дека интерферонот тип I е клучен рестриктивен фактор за CCHFV кај домаќинот цицач. Како домаќинот го чувствува CCHFV и го иницира вродениот имунолошки одговор in vivo е нејасно. Испитувањето како вродениот имунитет го контролира CCHFV и како CCHFV го антагонизира вродениот имунитет за да предизвика болест кај луѓето е тешко во моделите со недостаток на интерферон од тип I. Понатаму, иако недостатокот на интерферон од тип I резултира со длабоки дефекти во вродениот имунитет, овој недостаток веројатно се протега и на адаптивниот имунитет (прегледан во реф., збунувачки студии и за вродениот и за адаптивниот имунитет на CCHFV. Неодамна, беше изолиран сој на CCHFV прилагоден на глувци кој може да предизвика болест кај имунокомпетентни лабораториски соеви од див тип на глувци. Инфекцијата на глувците со овој вид на CCHFV прилагоден на глувци резултираше со воспалително производство на цитокини, високи вирусни оптоварувања во повеќе ткива, патологија во црниот дроб и слезината, а закрепнувањето беше поврзано со робустен хуморален и клеточен имунитет. Студиите кај глувците Ifnar-/- и Rag1-/- покажаа дека и интерферонот од тип I и адаптивните имунолошки одговори вршат контрола на CCHFV во овој модел, овозможувајќи истражување за тоа како имунолошките одговори на домаќинот го контролираат CCHFV. Секвенционирањето на овој вирус идентификуваше пет кодирачки мутации: две во вирусниот NP со една исто така мутира на вирусните NSs, една во NSm и две во L протеинот. Акумулацијата на мутации во овие вирусни протеини сугерира дека овие протеини се вклучени во патогенезата на CCHFV кај имунокомпетентните домаќини. Неочекувано, беше забележана пристрасност поврзана со полот во тежината на болеста, при што женските глувци во голема мера се отпорни на тешка болест. Потешката болест забележана кај машките глувци беше поврзана со слични корелации на лош исход кај човечките случаи на CCHF, како што се поголемо воспалително производство на цитокини, пролонгирана виремија и поголема ткивна патологија. Иако повремено се пријавуваат разлики поврзани со полот за CCHF, ќе бидат потребни дополнителни студии кои ги опфаќаат културните практики кои ги ставаат мажите во поголем ризик за изложеност на CCHFV за да се утврди дали слични полови разлики во исходот на болеста се присутни кај заразените луѓе.

Модели на крлежи
Досега, животинските модели претежно користеа CCHFV испорачан со игла и го испуштија придонесот на факторите кои произлегуваат од крлежите и крлежите во патогенезата на CCHFV. Како и многу други вируси кои се пренесуваат преку членконоги, CCHFV мора да циркулира и да се одржува и кај домаќините на крлежи и ‘рбетници. Овој животен циклус поставува ограничувања на вирусната еволуција и може да влијае на вирулентноста. Иако се развиени модели на хранење на крлежи во висока содржина, многу останува непознато за улогата и придонесот на крлежот во патогенезата на CCHF и CCHFV.
Третмани за CCHF
Терапевтските опции за CCHFV остануваат ограничени и повеќето се фокусирани на мешање со вирусната репликација или модулирање на одговорот на домаќинот на инфекцијата. Иако многу кандидати покажаа ветувачки претклинички податоци, податоците за клиничката ефикасност за повеќето остануваат ограничени.

Антивирусни третмани
До денес, нуклеозидниот аналог на рибавирин е единствениот антивирусен лек со директно дејство кој е широко користен клинички кај пациенти со CCHF. Сепак, употребата на рибавирин е контроверзна, со континуирана дебата за тоа дали третманот го подобрува исходот. Систематските мета-анализи укажуваат дека податоците што ја поддржуваат ефикасноста на рибавиринот против CCHFV се слаби поради факторите на збунување во пријавените збирки на податоци, а секоја корист веројатно бара ран третман. Студиите на животни исто така покажаа конфликтна ефикасност на рибавирин против CCHFV инфекција. Иако рибавиринот бил ефикасен кај смртоносно инфицираните глувци Stat1−/− и Stat2−/− хрчаци, две студии кај смртно инфицирани глувци Ifnar−/− не покажале заштита од смрт дури и со навремен третман. Кумулативно, податоците од луѓе инфицирани со CCHFV и од животински модели сугерираат дека рибавиринот има слаба ефикасност против CCHFV и дека секоја корист веројатно бара брз третман по позната изложеност. Ова е тешко да се постигне надвор од призната лабораторија или изложеност во здравствената заштита.
За разлика од рибавиринот, фавипиравир или дериват (H44) покажа значајни заштитни ефекти кај смртно инфицираните глувци, спречувајќи смрт и значително намалувајќи го вирусното оптоварување во клучните целни ткива на CCHFV. Третманот со фавипиравир или H44 може да се започне дури и неколку дена по инфекцијата, вклучително и кога глувците покажувале напредни знаци на болест, а сепак обезбедуваат значителни заштитни ефекти. Овие податоци сугерираат дека фавипиравир и сродните соединенија може да бидат ефективни кај пациенти кои се јавуваат во здравствените системи со напреден CCHF. Интересно, смртоносната рекрусцентна CCHFV инфекција беше забележана неколку недели по прекинот на третманот со фавипиравир кај заразени глувци, што укажува на тоа дека раниот третман со фавипиравир можеби нема целосно да го контролира вирусот. Фавипиравир исто така беше ефикасен кај циномолгус макаки инфицирани со CCHFV, намалувајќи ја виремијата и вирусното оптоварување во неколку ткива. Иако фавипиравир се покажа ветувачки во претклиничките животински модели, податоците за ефикасноста кај луѓето инфицирани со CCHFV се ограничени и потребни се клинички испитувања за да се утврди дали фавипиравир може да ги подобри исходите на пациентите со CCHF. 2′-Деокси-2′-флуороцитидин, исто така, покажа ветувачки резултати in vitro, што сугерира дека ова може да биде уште еден ефикасен антивирусен лек против CCHFV. Молнупиравир, неодамна користен за лекување на инфекција со SARS-CoV-2 кај луѓето, покажува ефикасност против CCHFV in vitro со слични инхибиторни концентрации како фавипиравир. Сепак, молнупиравир не успеа да заштити од инфекција со CCHFV кај смртно инфицираните глувци дури и кога третманот бил започнат пред инфекцијата.
Иако се смета дека рибавирин, фавипиравир и 2′-деокси-2′-флуороцитидин имаат антивирусно дејство преку катастрофална мутагенеза или инхибиција на вирусната репликаза, пријавени се дополнителни мали молекули кои дејствуваат преку различни механизми ефикасни против CCHFV in vitro. TH3289, соединение со широка антивирусна активност ин витро, се покажа дека ја потиснува репликацијата на CCHFV, веројатно со модулирање на интеракциите помеѓу вирусните протеини и клеточните шаперонски протеини. Блокадата на каталитичката активност на доменот CCHFV OTU со синтетичка варијанта на убиквитин беше во можност да ја блокира репликацијата на CCHFV ин витро преку интерференција со синтезата на вирусна РНК50. Сепак, потребна е дополнителна валидација на овие потенцијални антивирусни средства против CCHFV in vivo.
Терапии базирани на антитела
Покрај малите молекули, терапии базирани на антитела исто така се евалуирани за третман на CCHFV. Иако не се извршени големи испитувања, ограничените докази сугерираат дека администрацијата на плазма или антитела од преживеани од CCHF може да донесе корист кај сериозно болните пациенти. Сепак, приспособливоста на третманите со плазма за закрепнување е ограничена, а континуираните истражувања покажаа ефикасност на моноклоналните антитела на глувци и човечки против CCHFV кај смртоносно инфицирани глувци. Евалуацијата на панелот од моноклонални антитела на глувци кон вирусниот GPC покажа дека неколку неутрализирачки и ненеутрализирачки антитела може да ги заштитат смртно инфицираните неонатални глувци33. Сепак, некои антитела кои покажаа ефикасност кај неонаталниот модел не успеаја да ги заштитат смртоносно инфицираните возрасни глувци со недостаток на интерферон тип I40. Силно неутрализирачките антитела добиени од човечки преживеани CCHF не успеаја да ги заштитат смртно инфицираните глувци во пост-експозиција, иако хибридното бицистронско антитело можеше да заштити 80% од глувците кога им се администрираат 24 часа по инфекцијата. Бидејќи заштитата беше нецелосна дури и кога глувците беа третирани со голема количина (1 mg) од ова антитело само 24 часа по инфекцијата, потребни се дополнителни студии за да се дефинира терапевтскиот прозорец на неутрализирачки антитела за третман на CCHF. Иако CCHFV GPC е најразновиден сегмент, беше откриено дека подгрупата на антитела покажуваат широка активност на неутрализација.
Антиинфламаторни лекови
Тешкиот CCHF, како и многу хеморагични трески, вклучува нерегулиран инфламаторен одговор и цитокински бури што доведуваат до значителна имунопатологија. Така, направени се ограничени обиди да се користат антиинфламаторни лекови кај пациенти со CCHF за да се потисне хиперинфламаторниот одговор на домаќинот. Во компаративна студија на пациенти со потврден CCHF, високи дози на метилпреднизолон со рибавирин ги подобриле резултатите во споредба со само рибавирин. Кортикостероидите, исто така, се чинеше дека имаат корист кај тешко болните пациенти. Сепак, големината на групата на овие студии е ограничена. Една неодамнешна студија на смртоносно инфицирани глувци блокирани со интерферон тип I покажа дека инфекцијата на глувците на кои им недостасува TNF рецептор или третман со антитела за блокирање на сигнализацијата на TNF може да заштити од смртоносна болест. Достапноста на клинички одобрени TNF терапевти и терапевти против други цитокини домаќини може да гарантира евалуација на овој пристап за лекување на CCHF.
Превенција и вакцини
Иако антивирусни и терапии базирани на антитела за CCHFV покажаа ветување во претклиничките модели, корисноста на овие третмани е ограничена на добро развиени системи за здравствена заштита со способност за брзо препознавање и дијагностицирање на инфекции со CCHFV, пристап до лекови и можност за навремено започнете со третман. Терапиите за пациенти во земји со ограничени ресурси за здравствена заштита или презентирање на системите за здравствена заштита кога покажуваат напредна болест, најверојатно ќе останат ограничени. Следствено, едукацијата за јавно здравје за спречување на изложеност на CCHFV и вакцини е критично потребна за да се одговори на заканата за јавното здравје од инфекциите со CCHFV во области со ограничен пристап до здравствена заштита.
Превенција
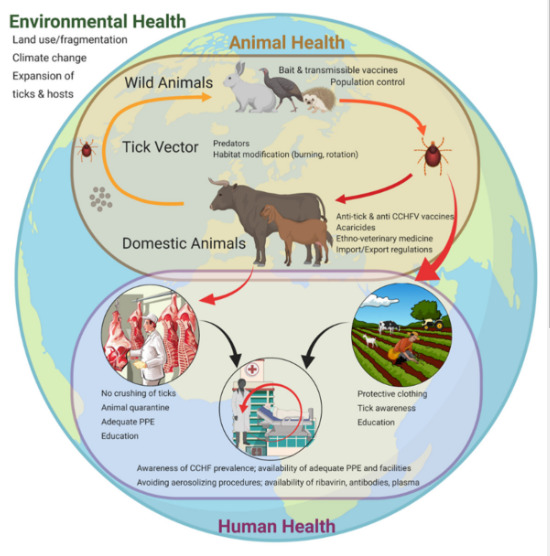
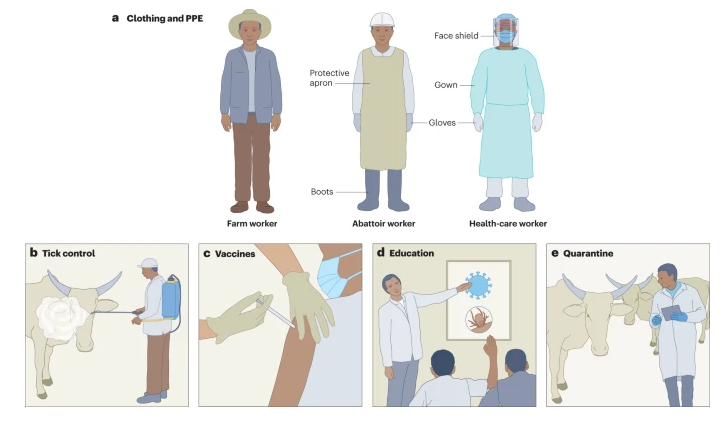
Спречувањето на CCHFV инфекција вклучува решавање на многу фактори на ризик за изложеност на CCHFV . За фармерите, носењето соодветна облека како долги ракави и панталони, намалувањето на активностите во областите заразени со крлежи и употребата на интегрирани стратегии за управување со штетници за намалување на популацијата на крлежи во околината на фармата може да го минимизира ризикот од CCHFV инфекција преку каснувања од крлежи. Понатаму, користењето заштитна опрема при колење добиток инвестиран во крлежи или во процесите на колење во двор или во кланици може да ја намали изложеноста преку контаминирани животински производи. Во услови на здравствена заштита, личната заштитна опрема е од суштинско значење за да се спречи преносот за време на грижата за пациентите инфицирани со CCHFV. Едукативните кампањи за информирање на луѓето во ендемските области за факторите на ризик за CCHF (како што се каснувања од крлежи и опасностите на работното место) може да ги поттикнат ризичните популации да го намалат ризикот од изложеност и да ги препознаат и пријават раните симптоми на CCHF . Карантин на добиток што потенцијално носи крлежи инфицирани со CCHFV или CCHFV пред транспортот или колењето, исто така, може да ја спречи изложеноста и да го ограничи внесувањето на CCHFV во нови области.
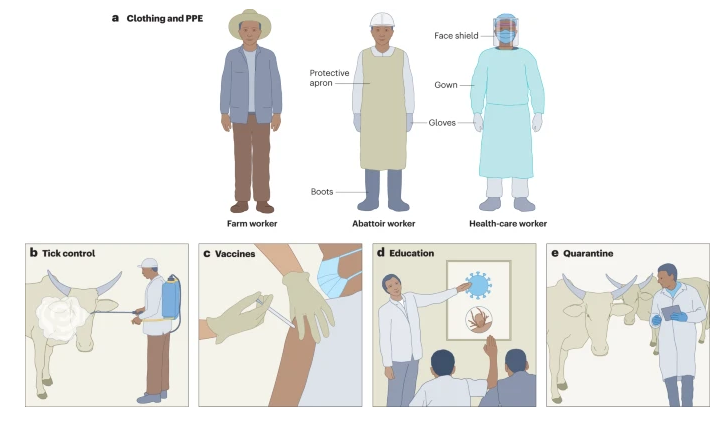
Превенцијата на Кримско-Конго хеморагична треска (CCHF) бара мултифакториелен пристап кој се однесува на јавното и ветеринарното здравје. a, Работниците на фармите треба да носат долги ракави и панталони за да го ограничат каснувањето од крлежи. Преносот на CCHF во здравствената заштита и кланиците може да се ограничи со носење соодветна лична заштитна опрема (ППЕ). Стандардна бариерна ППЕ како лабораториска наметка, ракавици, штит за лице и маска може да ја ограничи изложеноста на здравствениот персонал на контаминирани телесни течности. Работниците во кланиците можат да бидат на сличен начин заштитени со носење ОЛЗ како што се наметки и ракавици и добиваат соодветна обука за тоа како да касапат животни, контролата на векторот на крлежот е исто така важна и може да вклучува распоредување на акарациди за контрола на популациите на крлежи на фармата и на добитокот. в, вакцините се исто така критично потребни за да се спречи инфекција на вирусот CCHF (CCHFV) и исто така може да се распоредат кај популациите на добиток за да се прекине животниот циклус на CCHFV. г, образовните напори насочени кон јавното здравје може да помогнат да се информираат ризичните популации за да се намалат активностите што ги изложуваат на крлежи или добиток инфицирани со CCHFV, да се препознае ризикот од каснување од крлеж при преносот на CCHFV и навремено да се препознаат раните симптоми на CCHFV . д, Инспекцијата и карантинот на животните кои се движат од CCHFV-ендемичните области може да ја намалат изложеноста на луѓето на крлежи инфицирани со CCHFV и да спречат воведување на CCHFV во нови области.
Вакцини
До денес, повеќе платформи за вакцини се проценети во животински модели за CCHFV, како што се инактивирани вирусни препарати, вакцини за субјекти, VLPS, рекомбинантни вируси во живо-атинуи, репликација со вирусна вирусна векторска вакцина166 и нуклеински киселини Вакцини, многумина со ветувачка ефикасност. Овие вакцински пристапи кон CCHFV се опширно разгледани на друго место. Сепак, пејзажот на вакцината за CCHFV е сложен: неутрализирачките антитела предизвикани од вакцината не изгледаат ниту неопходни ниту доволни за заштита, неколку вирусни антигени можат да донесат заштита, а сепак истите вирусни антигени изразени од различни платформи за вакцини можат да донесат јасно различни нивоа на ефикасност.
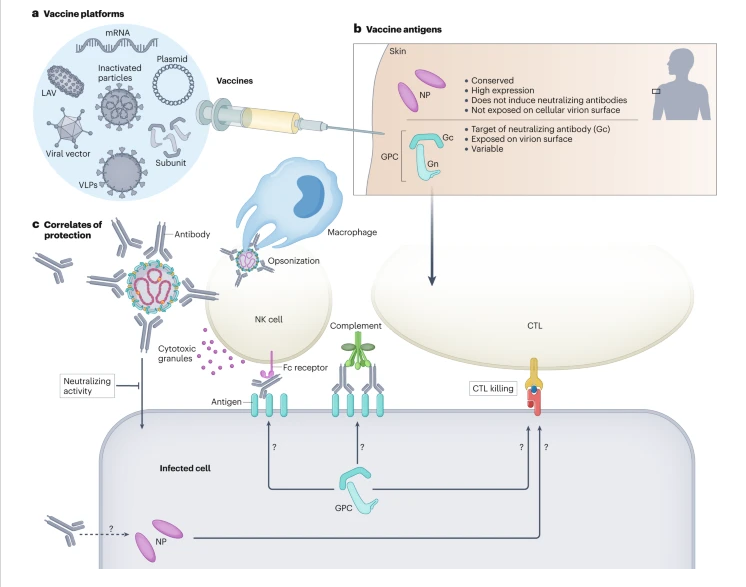
Повеќекратните платформи за вакцини за вирусот на хеморагична треска на Крим-Конго (CCHFV) достигнаа различни фази на претклиничко тестирање и вклучуваат вакцини базирани на нуклеинска киселина, како што се плазмидна ДНК и mRNA, инактивирани вирусни препарати, живи атенуирани вакцини (LAVs) како што е рекомбинантниот везикуларен стоматитис вирус, вирусно векторирани вакцини како што се вакцини векторирани со аденовирус, честички слични на вируси (VLPs) и вакцини под-единица со прочистени вирусни протеини . Вирусниот антиген изразен со овие вакцини веројатно е важен, со заштитна ефикасност докажана со вакцини кои изразуваат нуклеопротеин (NP) и/или гликопротеински прекурсор (GPC). Поважно е дека корелатите на заштитата за вакцините против CCHFV се непознати (дел в) и неутрализирачките антитела се незаменливи. Така, заштитата посредувана од вакцината може да бара ефекторни функции како што се вирусна опсонизација, активирање на комплементот или клеточна цитотоксичност зависна од антитела од природни клетки убијци (NK). Во студиите кои ја демонстрираат заштитната ефикасност на антителата само на CCHFV NP, останува нејасно како антителата кон NP можат да заштитат. Улогата на клеточниот имунитет како што е цитотоксичната цитотоксичност посредувана од Т-клетките е слично непозната. CTL, цитотоксичен Т-лимфоцит.
Предклиничките студии покажаа заштита со вакцини кои ги изразуваат CCHFV NP, GPC или само гликопротеините Gn и Gc, покажувајќи дека има повеќе заштитни епитопи во CCHFV. Во рамките на овие антигени, специфичните заштитни епитопи се нејасни. Глувците вакцинирани со ДНК плазмид што ги изразува само CCHFV Gn и Gc, но немаат MLD и GP38, развија анти-CCHFV антитела мерени со ензимски имуносорбентна анализа (ELISA), но не беа заштитени од смртоносна CCHFV инфекција. Сепак, имунитетот само на GP38 беше слабо заштитен. Епитопите насочени од НП-диригиран имунитет се непознати.
За да се избегне потребата за развој на вакцини специфични за соеви или специфични за регионот, вакцината за CCHFV мора да обезбеди заштита од генетски различни видови на CCHFV. Генетската разновидност на CCHFV е загрижувачка бидејќи ДНК вакцината што го изразува CCHFV GPC покажа нецелосна заштита кога глувците беа предизвикани со хетерологен вид на CCHFV, што покажува дека е можно вирусно бегство поради генетската разновидност на CCHFV. Спротивно на тоа, вакцините базирани на репликативна РНК (repRNA), вирус на везикуларен стоматитис и VLP покажаа хетеролошка заштита. Сепак, многу вакцини евалуирани во претклиничките модели го процениле само хомологниот предизвик и не е јасно колку широка или тесна е заштитата што ја даваат овие вакцини. Алтернативно, поголемиот дел од генетската разновидност на CCHFV се наоѓа во рамките на М сегментот што го кодира GPC. Вакцините вклучувајќи го поконзервираниот вирусен НП покажаа значителна ефикасност, а вакцините што изразуваат само NP можат да дадат силна заштита, што сугерира дека вклучувањето на НП може да го избегне вирусното бегство на имуно-конферентниот фактор.
Корелатите на заштитата посредувана од вакцината против CCHFV се слабо разбрани и се чини дека се помалку јасни од нивоата на неутрализирачки антитела индуцирани од вакцината (сл. 4в). Имено, вакцините базирани на repRNA, mRNA и ДНК покажаа значајна заштита кај глувците или NHP во отсуство на детектирачки неутрализирачки антитела по вакцинацијата . Спротивно на тоа, вакцините базирани на подединица и VLP предизвикаа високи нивоа на неутрализирачки антитела, но не успеаја да ги заштитат смртно инфицираните глувци , а заштитата не беше во корелација со неутрализирачките титри во споредбите помеѓу глувците вакцинирани со VLP и со ДНК-вакцинирани глувци . Иако робусните ELISA титри беа измерени кај глувци вакцинирани со ДНК вакцина која изразува Gn и Gc, но немаат MLD и GP38, глувците не беа заштитени од смртоносен предизвик . Сепак, кај глувци вакцинирани со repRNA вакцина, студиите кај глувци со дефицит на Б-клетки покажаа дека заштитата бара хуморален имунитет . Заедно, овие податоци покажуваат дека иако хуморалниот имунитет е важен, неутрализирачките антитела не се ниту неопходни ниту доволни за заштита посредувана од вакцина против CCHFV. Овие податоци, исто така, покажуваат дека ELISA и неутрализирачките титри може да не се доволни за да се предвиди ефикасноста на вакцината и дека е потребно подобро разбирање на корелатите на заштитата за CCHFV, што е важно разгледување додека платформите за вакцини преминуваат во клинички испитувања.
Овие податоци од вакцините додаваат на набљудувањата дека луѓето кои преживеале често не развиваат неутрализирачки антитела сè додека не се разреши клиничката болест91 и дека антителата кои не се неутрализираат можат да бидат ефективни терапевтски средства во претклиничките модели33. Така, функционалното барање на антитела предизвикани од вакцина против CCHFV за заштита изгледа сложено и може да бара ефекторни функции како што се активирање на комплементот или клеточна цитотоксичност зависна од антитела . Во студиите со глувци вакцинирани со repRNA, силната заштита од CCHFV беше во корелација со одговорите на антителата против CCHFV NP, но сепак овој антиген не беше достапен на непроменети инфицирани клетки in vitro , тврдејќи против механизмите како што се клеточната цитотоксичност зависна од антитела и активирањето на комплементот за вакцината -посредувана контрола на инфекцијата. NHP-и вакцинирани со плазмид што го изразува само NP имаа значителна заштита по предизвикот CCHFV174, што покажува дека заштитната ефикасност на NP антигенот не е артефакт на моделите на глувци. Како антителата на внатрешен CCHFV протеин може да донесат заштита бара дополнително проучување (сл. 4в). Слично на тоа, улогата на клеточниот имунитет предизвикан од вакцината во заштитата од CCHF е нејасна. Заштитата бара трансфер и на антитела и на Т-клетките од модифицирани глувци вакцинирани вакцини од Анкара, што сугерира дека и хуморалниот и клеточниот имунитет придонесуваат за заштита посредувана од вакцината. Спротивно на тоа, кај глувците вакцинирани со repRNA, исцрпувањето на Т-клетките во времето на вирусниот предизвик не го промени преживувањето, што сугерира дека клеточниот имунитет е неопходен за заштита. Иако е докажано дека повеќе вакцини предизвикуваат клеточен имунитет кај животинските модели, барањето за клеточен имунитет за заштита останува главно непроверено и може да биде вакцина.
Заклучоци
И покрај широкиот географски опсег и големите популации изложени на ризик за инфекција со CCHFV, останува многу да се утврди во врска со домаќинот и вирусните детерминанти на патогенезата на CCHFV. Новите функции на вирусните протеини веројатно останува да се откријат, а развојот на алатки за молекуларна вирусологија и подобрени модели на мали животни ќе овозможат дополнителен механички увид во тоа како CCHFV предизвикува болест. За ризичните популации, во ендемските области треба да се спроведат превентивни мерки како што се едукација, намален контакт со крлежи, третман на добиток за контрола на наездата од крлежи, карантин на добитокот и заштита од високоризични активности. Поважно, брза и сигурна дијагностика заедно со ефикасни вакцини и антивирусни средства се потребни за да се ограничи товарот на CCHF врз пациентите и системите за јавно здравје. Со оглед на тоа што вакцините може да штитат од CCHFV преку механизми различни од класичната неутрализација со посредство на антитела, испитувањето како вакцините штитат од CCHFV ќе обезбеди увид во тоа како домаќинот може да ја контролира инфекцијата и ќе ги информира стратегиите за третман кои промовираат ефективни имунолошки одговори додека ја ограничуваат имунопатологијата. Кумулативно, ќе бидат потребни континуирани придонеси од областите на молекуларната вирологија, имунологијата, вакцинологијата, ентомологијата, ветеринарното здравје и јавното здравје за да се одговори на значителниот ризик од CCHFV инфекција и болест во ендемските области.
ПРЕПОРАКА
Потсетник за читателите, не го пропуштајте нашиот последен поткаст за астмата со проф.Др Дејан Докиќ:



















